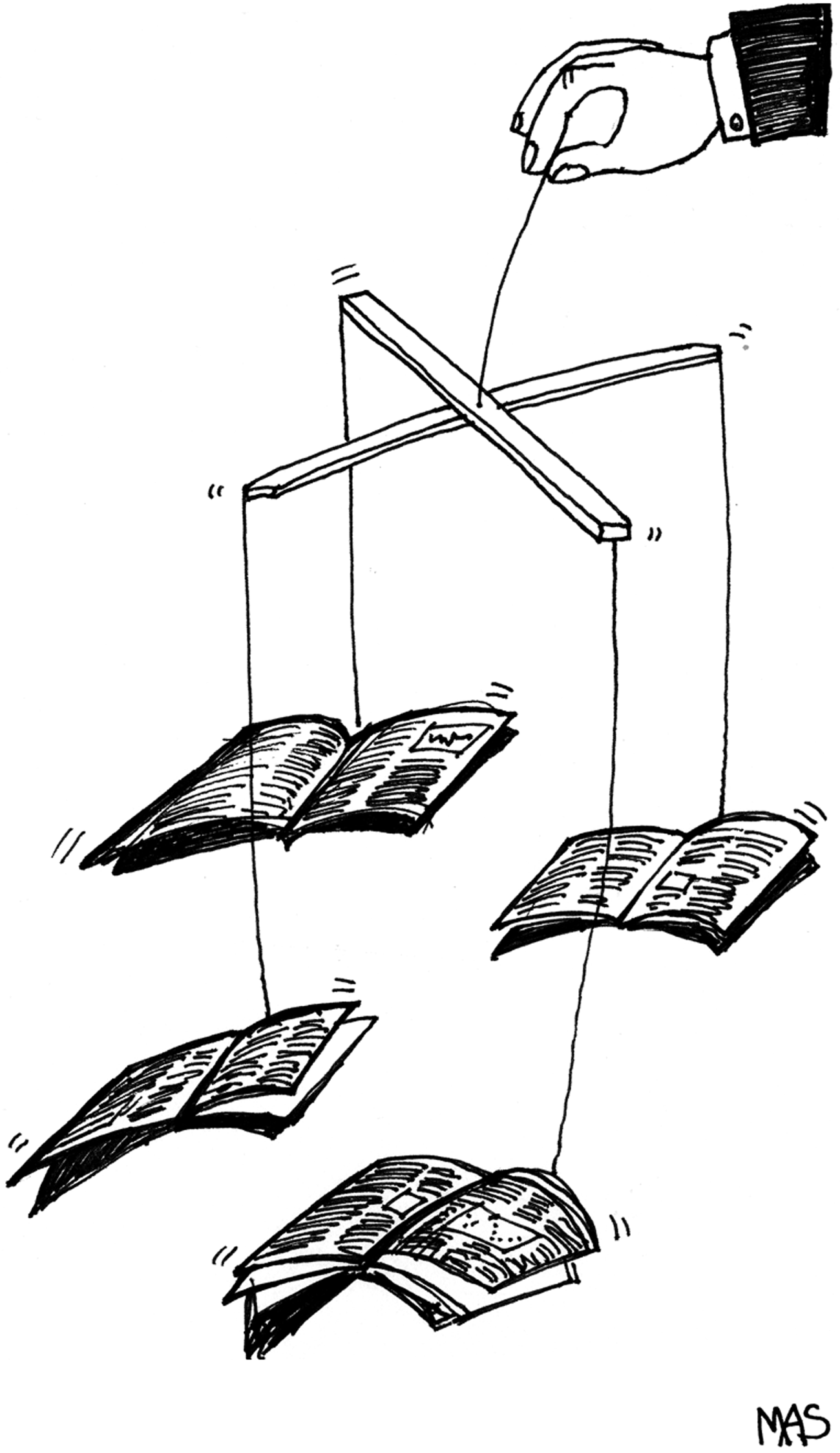
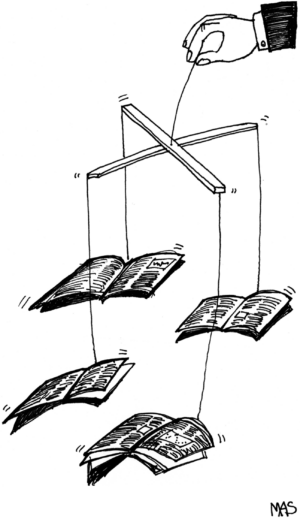
Medical Journals Are an Extension of the Marketing Arm of Pharmaceutical Companies
「本当は何があなたを病気にするのか?」下巻で[R9.62] として参照される元BMJ(ブリティッシュ・メディカル・ジャーナル)編集者リチャード・スミスによる記事です。
2004年3月、ランセット誌の編集者リチャード・ホートンは、「ジャーナルは製薬業界のための情報ロンダリング機関に成り下がった」と書いた[1]。同じ年、『ニューイングランド・ジャーナル・オブ・メディスン』誌の元編集者マーシャ・アンゲルは、製薬業界が「主としてマーケティング・マシン」と化し、「その邪魔になりそうなあらゆる機関」を吸収していると非難した[2]。しかし、業界の権力と影響力に危機感を募らせる編集者は、彼女とホートンだけではない。同じく『ニューイングランド・ジャーナル・オブ・メディシン』誌の元編集者であるジェリー・カッシーラーは、業界が多くの医師のモラルを偏向させていると主張し[3]、『PLoSメディシン』誌の編集者は、「ジャーナルと製薬業界との間の…依存のサイクルの一部」にはならないと宣言している[4]。何かが起きているのは明らかだ。
問題:広告よりもスポンサー付き臨床試験
医学雑誌が製薬業界に依存している最も顕著な例は、広告からの多額の収入だが、これは依存の最も少ない腐敗の形態と私は思う。広告はしばしば誤解を招くし [5,6]、その利益は数百万ドルに値するかもしれないが、広告はすべての人が見て批判できるものだ。医師は、そう信じたいと思うほど、広告には影響されないかもしないが、あらゆる分野において、一般大衆は広告主の主張を割り引いて考えることに慣れている。
より大きな問題としては、ジャーナルが発表するオリジナルの研究、特に臨床試験にある。割り引くこともほぼ無く、読者は、無作為化比較試験を最高の証拠とみなす。主要な学術誌に掲載された大規模な臨床試験は、(広告とは異なり)学術誌の承認印があり、世界中に配信される。特に学術誌と同時に、臨床試験のスポンサーである製薬会社が雇った高価な広告会社の両方からのプレスリリースによって同時に宣伝された場合、世界的なメディア報道を受ける可能性がある。製薬会社にとって、好意的な臨床試験は何千ページもの広告の価値があり、そのため、ある製薬会社は臨床試験の別刷りを世界中に配布するために100万ドル以上を費やすこともある。別刷りを受け取った医師は、それを読まないかもしれないが、その雑誌の名前に感銘を受けるだろう。ジャーナルの質が薬の質を授けるのだ。
これらの臨床試験への資金提供企業にとっては幸いだが、臨床試験の掲載雑誌の信頼性にとっては残念なことである。これらの臨床試験が企業の製品にとって不利な結果をもたらすことはほぼない [7,8] 。Paula Rochonと他の研究者は、1994年に関節炎の非ステロイド性抗炎症薬のメーカーが資金提供した発見できる限りのすべての臨床試験を調査した。彼らは56の臨床試験を発見したが、発表された臨床試験の中で、臨床試験のスポンサーである企業に不利な結果を示したものは一つもなかった。どの臨床試験でも、その会社の薬が比較対照薬と同等かそれ以上であることが示された。
2003年までに、製薬企業からの資金提供研究の結果と、それ以外の資金源からの研究の結果を比較する30件の研究の系統的レビューが可能になった [8] 。そのうちの16件は臨床試験またはメタ解析(訳注:複数の研究の結果を統合し、より高い見地から分析すること)で、13件はスポンサー企業に有利な結果であった。全体として、企業から資金提供された研究は、他の資金源から資金提供された研究よりも、企業に有利な結果をもたらす可能性が4倍高かった。経済的評価(訳注:高すぎない医療費)を調査した5つの研究では、結果はすべてスポンサー企業に有利なものであった。
これは、企業がその欲する結果を得ていることを示す強力な証拠であり、主要ジャーナルに掲載の臨床試験の2/3から3/4は、企業からの資金提供のため、特に憂慮すべきことである[9]。つまり、Annals of Internal Medicine、JAMA、Lancet、New England Journal of Medicineの各誌である。BMJでは1/3に過ぎないが、おそらく、製薬会社の収入の半分を占める北米において、同誌の影響力が他誌より小さいためであり、また、同誌がクラスター無作為化試験(通常これは薬物試験ではない)をより多く掲載しているためでもある[9]。
なぜ製薬会社は思い通りの結果を出せるのか?
なぜ製薬会社は思い通りの結果を得るのだろう?なぜ学術雑誌の査読システムは、偏った結果と思われるものに気づかないのだろうか?2003年に行われたシステマティック・レビュー(訳注:再調査のこと)では、製薬企業による資金提供の研究の技術的な質が、他の企業がによる資金提供の研究よりも優れていることが明らかになった [8]。企業は莫大な資金を持ち、最高水準の試験を実施することに精通しているため、これは驚くべきことではない。
企業は、あまりに粗雑で査読で見破られる可能性のある結果をいじくり回すのではなく、むしろ「正しい」質問によって、望む結果を得ているようである。有利な結果を得るための方法のいくつかをサイドバーにあげたが、有利な結果を出す可能性を大幅に高める方法はたくさんあり、新たな方法を考え出し、査読者の一歩先を行く雇われ人もたくさんいる。
そして、肯定的な結果を最大限に露出させるための、様々な出版戦略が利用可能だ。企業は、否定的な研究を抑制することに頼ってきた [11,12]が、これは粗雑な戦略であり、企業が「正しい」質問をしていれば、ほとんど必要ないはずの戦略である。より良い戦略は、肯定的な結果の複数回発表であり、多くの場合は学術雑誌の付録である。これは出版社にとって非常に儲かり、品質の疑わしさが示されているものだ[13,14]。企業は通常、多機関共同試験を実施し、様々な時期に様々な機関から得られる様々な結果を、様々なジャーナルに掲載する大きな余地ができる。また、様々な機関の結果を複数組み合わせて発表することも可能だ。
このような戦略は、リスペリドン[15](訳注:非定型抗精神病薬)やオダンセトロン[16](訳注:抗がん剤等による薬物性嘔吐の予防および治療)のケースで露呈しているが、いくつの試験が真に独立のもので、いくつの試験が単に同じ結果を複数回発表しているだけなのかを発見するのは大変な労力を要する。そして通常、発表された研究からそれを見分けることは不可能である。著者のところに行って個々の患者のデータを入手する必要がある。
査読は問題を解決しない
ジャーナル編集者は、自分たちがどのように操作されているかに気づきつつあり、反撃している[17,18]。しかし、告白せねばならないが、私がBMJの編集に携わるようになってから、起こっていることに気づくまでに四半世紀近くかかってしまった。編集者の仕事は、提出された研究を検討することである。関連する研究があれば著者に送ってもらうが、編集者には他にどのような未発表研究があるかを知る仕組みがない。出版済の関連研究を知ることさえ難しく、同じ患者から得られた結果を記述している研究であることが見分けられない場合もある。このように、編集者は巨大で賢いマーケティング・ジグソーパズルの一片を査読するに過ぎない。そして、その一片は技術的に質の高いものである可能性が高い。おそらくこれは査読を通過するだろう。査読というプロセスは、偏見や乱用が起こりやすい非効率的な抽選であることが、研究によって明らかにされている[19] 。
さらに、編集者は無作為化試験を好む可能性が高い。多くのジャーナルはそういった臨床試験をほとんど掲載しておらず、もっと掲載したいと考えている。こういった試験はまた臨床的に興味深い可能性が高い。それ以外の掲載理由は、それほど価値のあるものではない。出版社は、製薬会社が数千ドル分の別刷りを購入することが多く、別刷りの利益率は70%であることがわかっている。編集者もまた、そういう研究の出版が非常に儲かると知っており、編集者はジャーナルの予算とオーナーへの利益にますます責任を負うようになっている。オーナーも学会の場合もあるが、それも含めて彼らはジャーナルからの利益に依存している。そのため、編集者は、10万ドルの利益をもたらす試験を出版するか、編集者を解雇して年度末の予算を達成するかという、恐ろしく厳しい利害の対立に直面する可能性がある。
ジャーナルは臨床試験を批判すべきであり、掲載すべきではない
ジャーナルが製薬会社のマーケティング部門の延長線上になってしまい、その製品に有利な臨床試験を掲載することを防ぐにはどうしたらよいだろうか。編集者は、プロトコルをレビューでき、臨床試験を登録するよう主張でき、スポンサーの役割を透明化するよう要求でき、そして、研究者が掲載の決定を支配しない限りは、臨床試験の掲載拒否ができる[17,18]。しかし、このような手段で大きく変えられるかは疑問だ。もっと根本的なことが必要なのである。
まず第一に、臨床試験、特に、ある疾患の治療に利用可能なすべての治療法に関する大規模な直接比較試験に対する公的助成を増やす必要がある。第二に、ジャーナルが臨床試験の掲載をやめることである。その代わり、プロトコルと結果を規制されたウェブサイト上で公開すべきだ。このようなラジカルな一歩でのみ、企業はジャーナルを言いなりにさせられなくなるだろう。臨床試験の掲載ではなく、ジャーナルは臨床試験に対する批判的な記述に集中できるだろう。
製薬会社が臨床試験で望む結果を得るための方法例
- 自社の医薬品を、劣ることが分かっている治療法と比較する試験を実施する。
- 競合薬の低用量との比較試験を行う。
- 競合薬の高用量に対して自社薬の試験を行う(自社薬の毒性を低く見せる)。
- 競合薬との違いを示すには少なすぎる試験を実施する。
- 試験で複数のエンドポイントを使用し、好ましい結果が得られたものを選んで公表する。
- 多機関共同試験を実施し、好ましい結果が得られた機関から結果を選んで公表する。
- サブグループ解析を実施し、好ましい結果を選んで公表する。
- 最も印象に残りやすい結果を発表する。例えば、絶対リスクよりも相対リスクの減少など。
謝辞
本稿は、2004年10月にリチャード・スミスがロンドン医学会で2004年度ヘルスウォッチ賞を受賞した際に行った講演に基づいている。この講演は、2005年1月のヘルスウォッチ・ニュースレターで報告されている[20]。この記事は、BMJ誌に掲載された記事と若干重複している [21]。
リファレンス
- 1.Horton R (2004) The dawn of McScience. New York Rev Books 51(4): 7–9.
- 2.Angell M (2005) The truth about drug companies: How they deceive us and what to do about it. New York: Random House. 336 p.
- 3.Kassirer JP (2004) On the take: How medicine’s complicity with big business can endanger your health. New York: Oxford University Press. 251 p.
- 4.Barbour V, Butcher J, Cohen B, Yamey G (2004) Prescription for a healthy journal. PLoS Med 1: e22.
- 5.Wilkes MS, Doblin BH, Shapiro MF (1992) Pharmaceutical advertisements in leading medical journals: Experts’ assessments. Ann Intern Med 116: 912–919.
- 6.Villanueva P, Peiro S, Librero J, Pereiro I (2003) Accuracy of pharmaceutical advertisements in medical journals. Lancet 361: 27–32.
- 7.Rochon PA, Gurwitz JH, Simms RW, Fortin PR, Felson DT, et al. (1994) A study of manufacturer-supported trials of nonsteroidal anti-inflammatory drugs in the treatment of arthritis. Arch Intern Med 154: 157–163.
- 8.Lexchin J, Bero LA, Djulbegovic B, Clark O (2003) Pharmaceutical industry sponsorship and research outcome and quality. BMJ 326: 1167–1170.
- 9.Egger M, Bartlett C, Juni P (2001) Are randomised controlled trials in the BMJ different? BMJ 323: 1253.
- 10.Sackett DL, Oxman AD (2003) HARLOT plc: An amalgamation of the world’s two oldest professions. BMJ 327: 1442–1445.
- 11.Thompson J, Baird P, Downie J (2001) The complete text of the independent inquiry commissioned by the Canadian Association of University Teachers. The Olivieri report. Toronto: Lorimer. 584 p.
- 12.Rennie D (1997) Thyroid storm. JAMA 277: 1238–1243.
- 13.Rochon PA, Gurwitz JH, Cheung M, Hayes JA, Chalmers TC (1994) Evaluating the quality of articles published in journal supplements compared with the quality of those published in the parent journal. JAMA 272: 108–113.
- 14.Cho MK, Bero LA (1996) The quality of drug studies published in symposium proceedings. Ann Intern Med 124: 485–489.
- 15.Huston P, Moher D (1996) Redundancy, disaggregation, and the integrity of medical research. Lancet 347: 1024–1026.
- 16.Tramèr MR, Reynolds DJM, Moore RA, McQuay HJ (1997) Impact of covert duplicate publication on meta-analysis: A case study. BMJ 315: 635–640.
- 17.Davidoff F, DeAngelis CD, Drazen JM, Hoey J, Hojgaard L, et al. (2001) Sponsorship, authorship, and accountability. Lancet 358: 854–856.
- 18.De Angelis C, Drazen JM, Frizelle FA, Haug C, Hoey J, et al. (2004) Clinical trial registration: A statement from the International Committee of Medical Journal Editors. Lancet 364: 911–912.
- 19.Godlee F, Jefferson T (2003) Peer review in health sciences, 2nd ed. London: BMJ Publishing Group. 367 p.
- 20.Garrow J (2005 January) HealthWatch Award winner. HealthWatch 56: 4–5.
- 21.Smith R (2003) Medical journals and pharmaceutical companies: Uneasy bedfellows. BMJ 326: 1202–1205.
コメント